Cosa è Generation HD 1
Si tratta di uno studio clinico randomizzato, multicentrico, in doppio cieco, versus placebo, di fase III per valutare l’efficacia e la sicurezza del farmaco RO7234292 (RG6042), somministrato per via intratecale in pazienti sintomatici con malattia di Huntington.
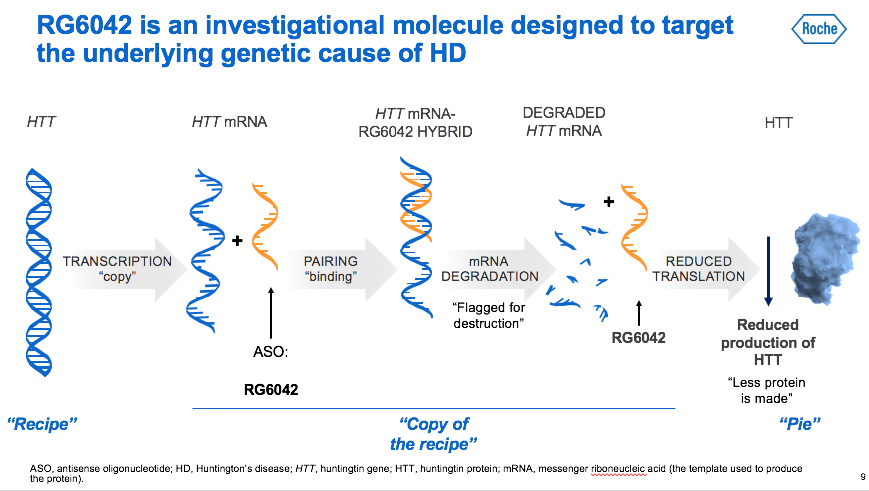
Come funziona la molecola sperimentale ASO (Oligonucleotide Anti Senso) denominato 'tominersen' (in precedenza RG6042)
Per la prima volta nella storia della malattia di Huntington viene sperimentata nell’uomo una molecola che colpisce direttamente la causa della malattia, ovvero riducendo l’RNA messagero che dal gene favorisce la formazione della proteina huntingtina (mHTT). La proteina HTT che, quando mutata (mHTT), determina la morte dei neuroni in alcune aree del cervello e ne causa l’insorgenza e la progressione dei sintomi. La strategia usata nello studio Generation HD 1 non è selettiva, motivo per cui vengono ridotte sia l’huntingtina mutata (mHTT), ereditata dal genitore che trasmette la malattia, che l’HTT, cioè quella non mutata ereditata dal genitore non portatore o non ammalato.
Cosa sono gli ASO
Le informazioni sul funzionamento delle nostre cellule sono contenute nel DNA. Il DNA deve essere trascritto in RNA messaggero perché poi questa informazione possa essere tradotta dai ribosomi adibiti a “fabbricare” le proteine. Il farmaco antisenso è un piccolo pezzo di DNA sintetico che si appaia all’RNA messaggero bloccandone la traduzione. In persone con il gene mutato per l'huntingtina, gli ASO sono tesi a bloccare, quindi, la produzione dell'RNA messaggero che ordina alle cellule di produrre la proteina HTT e mHTT.
Uno studio globale
Si tratta del più vasto studio clinico finora condotto per la malattia di Huntington.
Coinvolge 801 partecipanti, 19 Paesi e più di 100 siti al mondo.
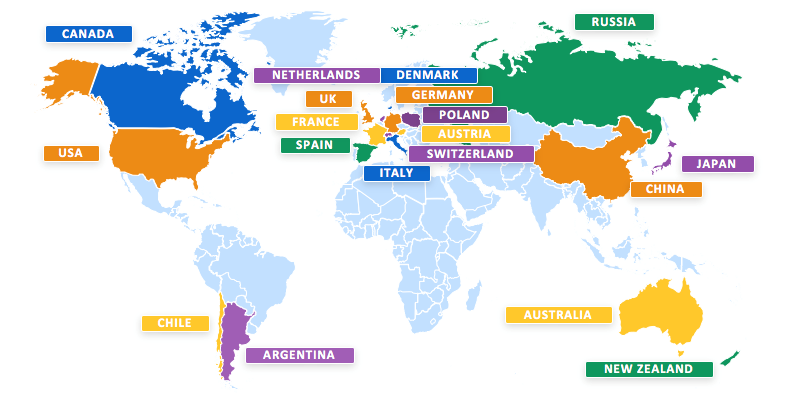
In Italia lo studio coinvolge circa 50 pazienti ed è condotto in sei Centri:
IRCCS Casa Sollievo della Sofferenza (Centro Coordinatore)
Principal Investigator: Ferdinando Squitieri
IRCCS Istituto Neurologico Carlo Besta di Milano
Principal investigator: Caterina Mariotti
Ospedale Sant’Andrea di Roma – Dipartimento di Neuroscienze
Principal Investigator: Giovanni Ristori
Università degli Studi DINOGMI di Genova
Principal Investigator: Giovanni Abbruzzese
Ospedale ISNB di Bologna
Principal Investigator: Pietro Cortelli
Ospedale Careggi di Firenze
Principal Investigator: Alessandro Sorbi
Durata
La durata prevista è di 25 mesi più follow-up. In Italia, la fase III è cominciata a luglio del 2019.
Criteri di inclusione
Possono partecipare allo studio pazienti sintomatici in fase iniziale di malattia. I criteri specifici sono:
- Diagnosi genetica di malattia di Huntington
- Età 25-65
- CAP score >400 (ottenuto da un’equazione che include l’età e la lunghezza del tratto mutato)
- Independence Scale ≥70
- Autonomia nel camminare, nel parlare e nel comprendere e firmare il consenso informato
Disegno dello studio e tempi di somministrazione
- 267 partecipanti ricevono 120 mg di farmaco ogni 2 mesi
- 267 partecipanti ricevono 120 mg di farmaco ogni 4 mesi (ogni due mesi ricevono placebo)
- 267 partecipanti ricevono 120 mg di placebo ogni 2 mesi
- Lo studio prevede anche l’utilizzo, non solo durante le visite ma anche quotidianamente a casa, di smartphone e smartwatch.
Modalità di somministrazione
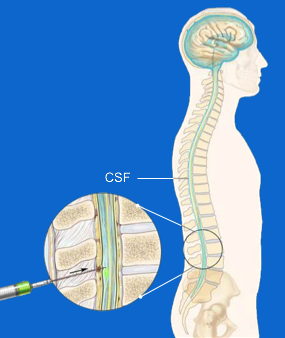
Gli ASO non sono in grado di arrivare direttamente al cervello a causa dell’esistenza di una sorta di ‘muro difensivo’ che il nostro corpo ha sviluppato attorno al sistema nervoso centrale; tale ostacolo prende il nome di ‘barriera ematoencefalica’ . Se da un lato questo sistema permette un’efficace protezione di del nostro cervello, dall’altro richiede che i farmaci pensati per agire sul sistema nervoso centrale siano infiltrati in altro modo. RG6042 è una terapia antisenso somministrata per via intratecale, ovvero attraverso una puntura lombare, in questo modo, venendo iniettata direttamente nel liquido che avvolge il sistema nervoso, è quindi in grado di agire su di esso scavalcando il “muro protettivo”.
La molecola sarà risultata efficace se...
...Se avrà rallentato la progressione dei sintomi e migliorato l’autonomia.
Gli indicatori di valutazione della efficacia del farmaco saranno punteggi rispetto ad alcune specifiche scale di valutazione che misurano il livello delle abilità funzionali, cognitive e motorie di chi ha assunto il farmaco, rispetto a chi ha assunto il placebo.
Conclusione stimata dello studio:
metà del 2022.
Cos’altro sappiamo di questo farmaco?
A partire da agosto 2015 si è iniziato a sperimentare questo farmaco su un gruppo di pazienti che ha preso parte alla prima fase dello studio. In questa fase sono state coinvolte 46 persone, a 34 è stato somministrato il farmaco a livelli di dose crescente (da 10 mg fino a 120 mg); a 12 è stato somministrato il placebo. Lo studio è durato sei mesi, nei primi quattro sono state effettuate le infusioni del prodotto investigativo ogni 28 giorni, nei mesi successivi si è monitorato l’andamento della concentrazione della proteina mutata nel liquor e la salute dei partecipanti. Durante lo studio non si sono verificati eventi avversi gravi né si sono registrati cambiamenti avversi clinicamente rilevanti nelle analisi di laboratorio. Il trattamento con il farmaco ha portato ad una riduzione dose-dipendente della concentrazione della proteina mHTT nel liquor (le variazioni medie oscillano dal 20 al 42% a livelli di dosaggio crescenti). Questo risultato conferma che il prodotto sperimentale è in grado di ridurre la concentrazione di mHTT.
Ma allora cosa non sappiamo ancora?
Dati i risultati di questo studio, non sappiamo se la riduzione della concentrazione di Huntingtina registrata nel liquor sia correlata a una riduzione di concentrazione nel sistema nervoso centrale (anche se gli studi preclinici sostengono questa ipotesi). Inoltre, sebbene ci sia un fondamento logico per aspettarsi effetti clinici positivi in relazione ad un abbassamento della concentrazione di mHTT, non ci sono ancora prove che l‘associno ad un effetto terapeutico sul decorso della malattia. È per questo che la terza fase di sperimentazione attualmente in corso è così importante, ci dirà di più sull’ effettiva efficacia del farmaco e ci permetterà di continuare a monitorare anche la sicurezza!


